|
|
FDA Dissolution Methods Database
В этой статье мы расскажем о базе данных FDA Dissolution Methods Database по методикам проведения теста Сравнительной кинетики растворения и теста Растворение. Данная база данных является незаменимым инструментом для разработчиков воспроизведенных лекарственных препаратов.
Варианты поиска по базе данных:
Общие сведения:
- Владелец базы:Агентство по контролю за качеством пищевых продуктов и лекарственных препаратов США (Food and drug administration, FDA)
- Непосредственный разработчик: Division of Bioequivalence, Office of Generic Drugs
- Доступ: открытый, бесплатный
- Обновление: ежеквартально
- Цель: предоставить рекомендации по условиям проведения СТКР для лекарственных препаратов, монографии на которые отстутствуют USP
- Основные пользователи: производители воспроизведенных лекарственных препаратов
- Количество препаратов: 1084 (по состоянию на июль 2015)
- Лекарственные формы: около 80 % - твердые дозированные лекарственные формы (таблетки и капсулы), остальные - суспензии для внутреннего применения, суспензии для инъекций, офтальмологические суспензии, суппозитории, порошки, жевательные таблетки, трансдермальные пластыри, вагинальные кольца и др.
Таблица результатов поиска включает следующие компоненты:
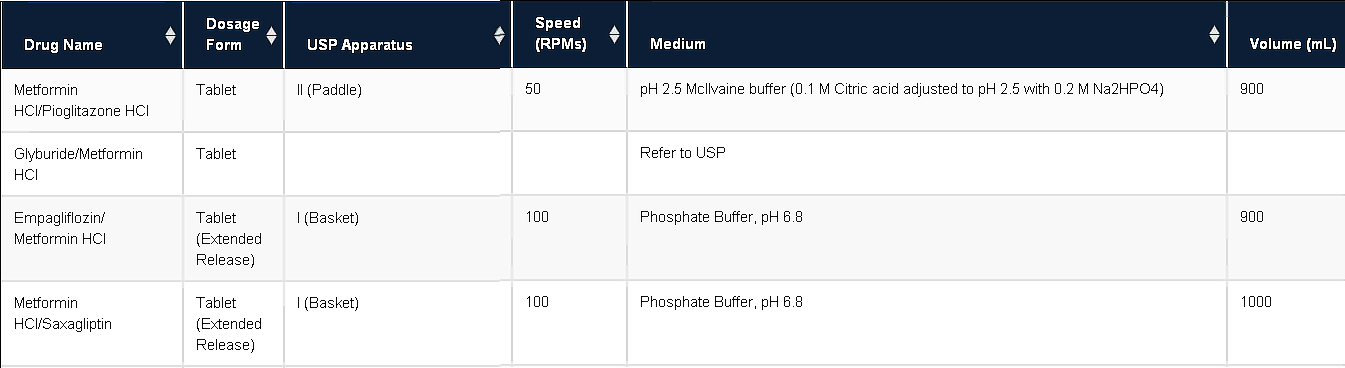
- Drug Name - Международное непатентованное или группировочное название лекарственного вещества
- Dosage Form - Готовая лекарственная форма (таблетки, капсулы, суппозитории, суспензии, гранулы, трансдермальные пластыри и др.)
- USP Apparatus - Тип аппарата согласно фармакопее США. Самые распространенные: Лопастная мешалка (Apparatus II) и Вращающаяся корзинка (Apparatus I)
- Speed (RPMs) - Скорость вращения перемещивающего устройства, об/мин
- Medium - Среда растворения. Приготовление большинства сред растворения описано в фармакопее США. Для некоторых сред указана только концентрация.
- Volume (mL) - Объем среды растворения (обычно 900 мл, 500 мл или 1000 мл)
- Recommended Sampling Times (minutes) - Рекомендуемые временные точки отбора, необходимые для получения полноценного профиля высвобождения.
- Date Updated - Дата последнего обновления базы, относительно конкретного ЛП.
Важные примечания:
- После публикации в фармакопее США монографии на соответствующий лекарственный препарат в базе данных появляется запись "Refer to USP".
- Производители дженериков обычно используют рекомендации FDA при разработке методики проведения теста "Растворение". При проведении экспертизы регдосье в России ссылки на FDA Dissolution Methods Database достаточно для обоснования условий растворения.
- Однако, следует иметь ввиду, что приведенные условия растворения могут быть заимствованы FDA у компании-оригинатора и плохо подходить для других вариантов состава препарата.
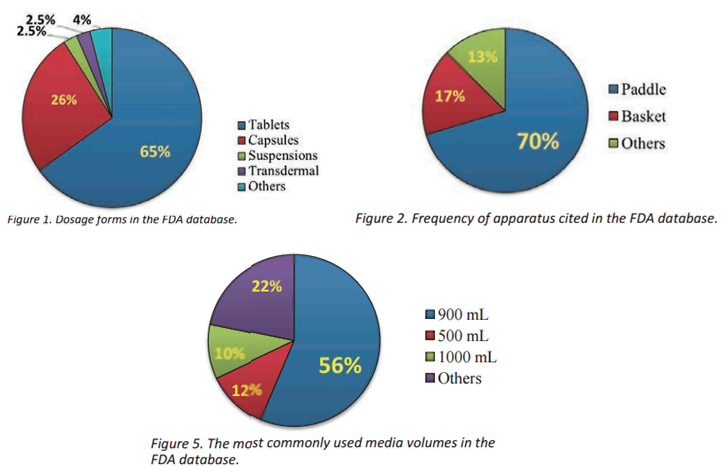
В журнале Dissolution Technologies (August 2016) приведена любопытная статистика:
|


